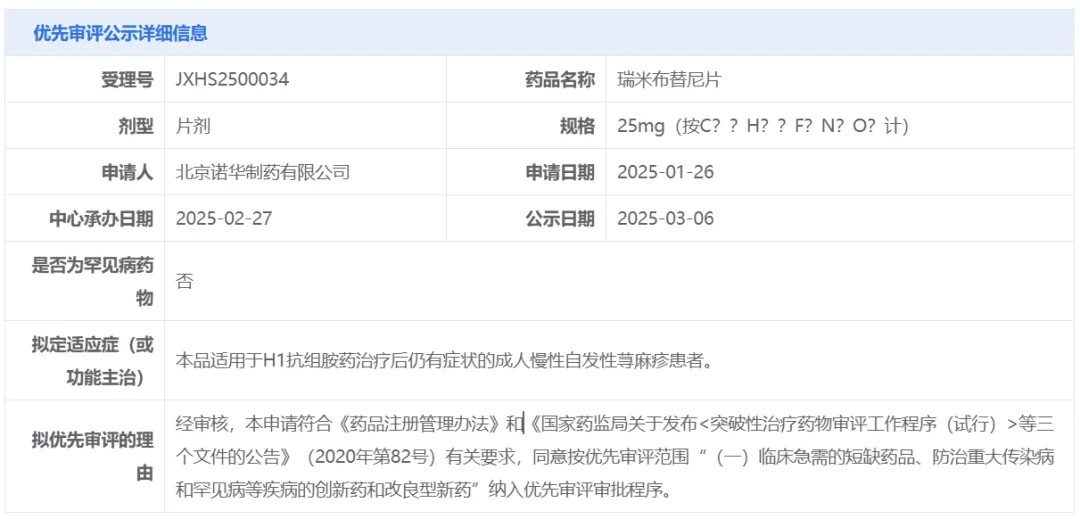
【AAD 2025】慢性自发性荨麻疹治疗新格局——BTK抑制剂
瑞米布替尼 Remibrutinib
3月6日,中国国家药监局药品审评中心(CDE)官网发布公示[1],诺华(Novartis)提交的1类新药瑞米布替尼片的上市申请拟纳入优先审评程序。该药物适用于H1抗组胺药治疗后仍有症状的成人慢性自发性荨麻疹(CSU)患者。这项上市申请此前已于今年2月27日获得CDE正式受理。
公开资料显示,瑞米布替尼(remibrutinib)是诺华在研的一款BTK抑制剂,其首发适应症为治疗慢性自发性荨麻疹。针对该适应症的3期临床研究已经取得积极结果,患者接受瑞米布替尼治疗后,最早在一周内其CSU症状即获得改善,并持续至52周。值得一提的是,这是瑞米布替尼在全球范围内首次提交上市申请。
除CSU外,瑞米布替尼在治疗其它免疫介导的炎症性疾病方面的研究也正在进行中,如化脓性汗腺炎,该药在2期研究中达到了主要终点;与此同时,瑞米布替尼治疗食物过敏、慢性诱导性荨麻疹和多发性硬化等疾病的研究也在进行中。
AAD 2025 相关摘要如下[2-3]:

在第52周评估的最新长期3期REMIX-1和REMIX-2数据显示[4]:
· 与安慰剂相比,瑞米布替尼在第12周所展现的显著的症状改善持续至第24周,具体体现在每周荨麻疹活动度评分(UAS7)、每周瘙痒严重程度评分(ISS7)和每周风团数量评分(HSS7)等指标的显著改善。
· 接受安慰剂治疗的患者在第24周转为接受瑞米布替尼治疗;在换药后的第一周即可观察到对瑞米布替尼的治疗应答,且作用持续至研究结束(即28周的治疗)。
· 根据第52周的评估结果,近半数患者完全无瘙痒和荨麻疹症状(UAS7=0)。
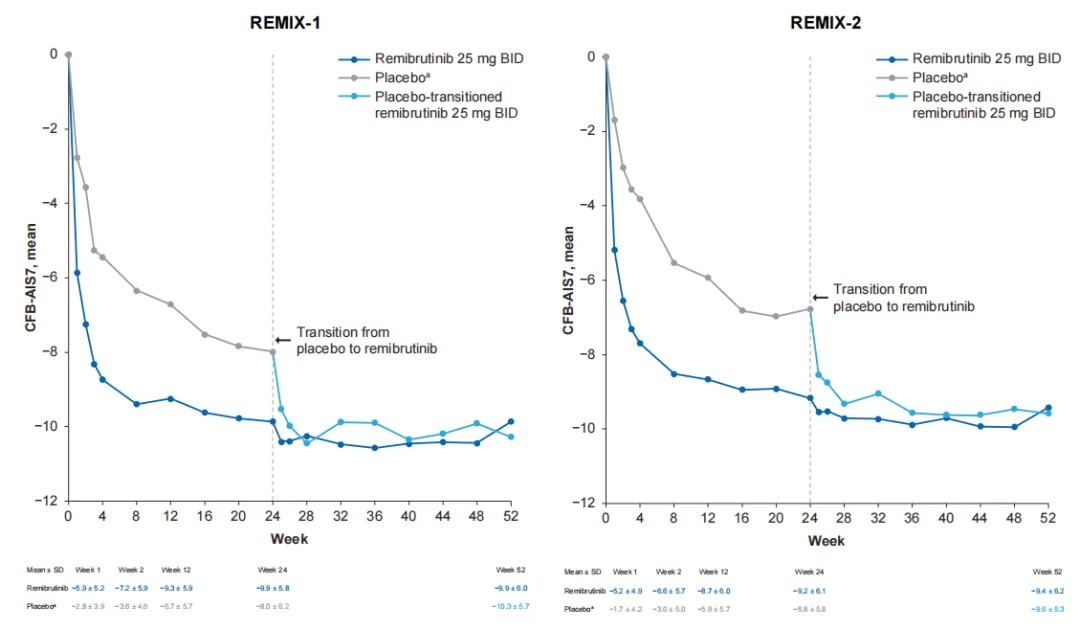
· 与安慰剂相比,接受瑞米布替尼治疗的患者在第 1 周时,相对于基线患者的每周睡眠干扰评分(SIS7)和每周活动干扰评分(AIS7)变化已有更大改善,且这种改善持续到第 24 周。
· 在研究中,瑞米布替尼还具有良好的耐受性,并在长达52周的治疗中表现出良好且稳定的安全性,其肝功能检测结果与安慰剂组相近。此外,长期接受治疗并不会增加与治疗相关的不良事件发生的风险。瑞米布替尼治疗组和安慰剂组的肝转氨酶升高情况相近,表现为无症状、一过性且可逆。研究人员认为未发生任何与研究药物相关的严重不良事件。
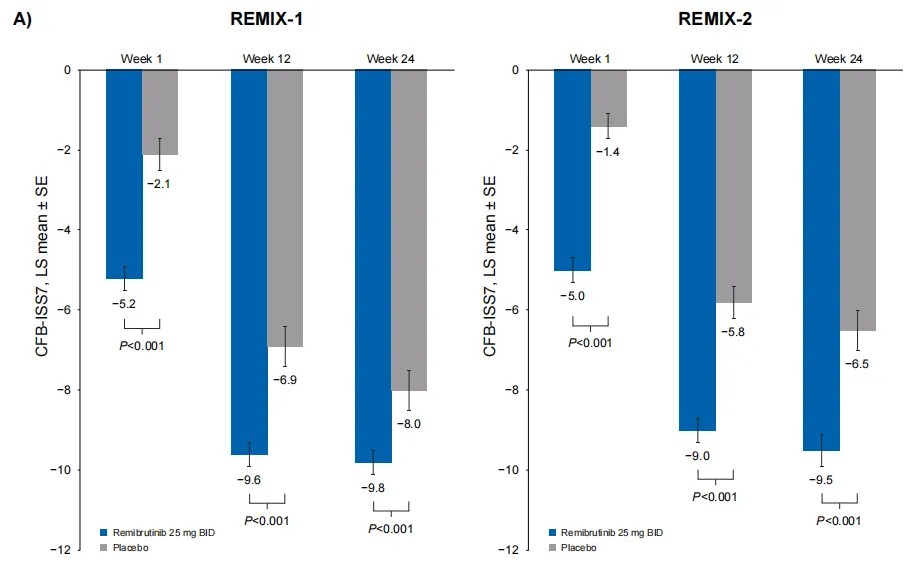
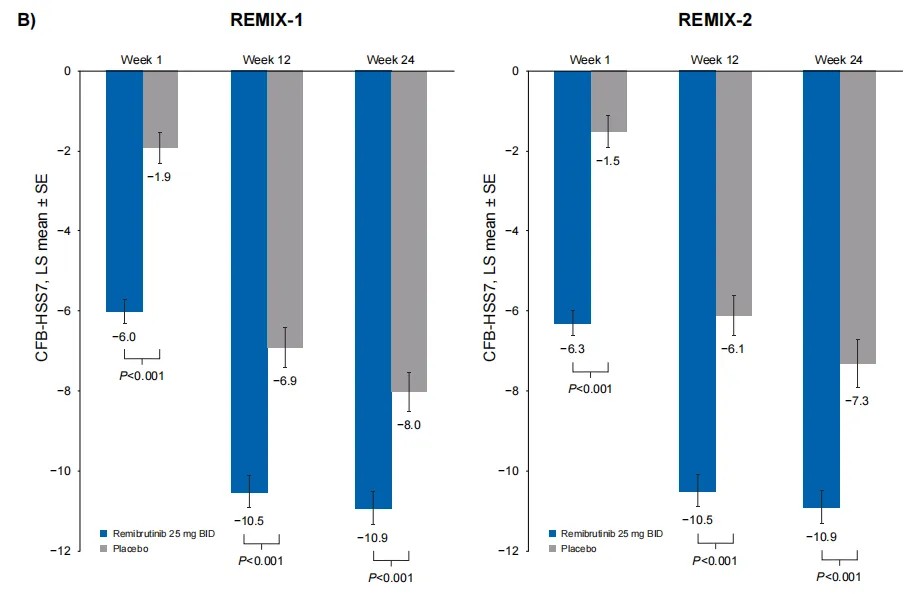
ISS7:每周瘙痒严重程度评分
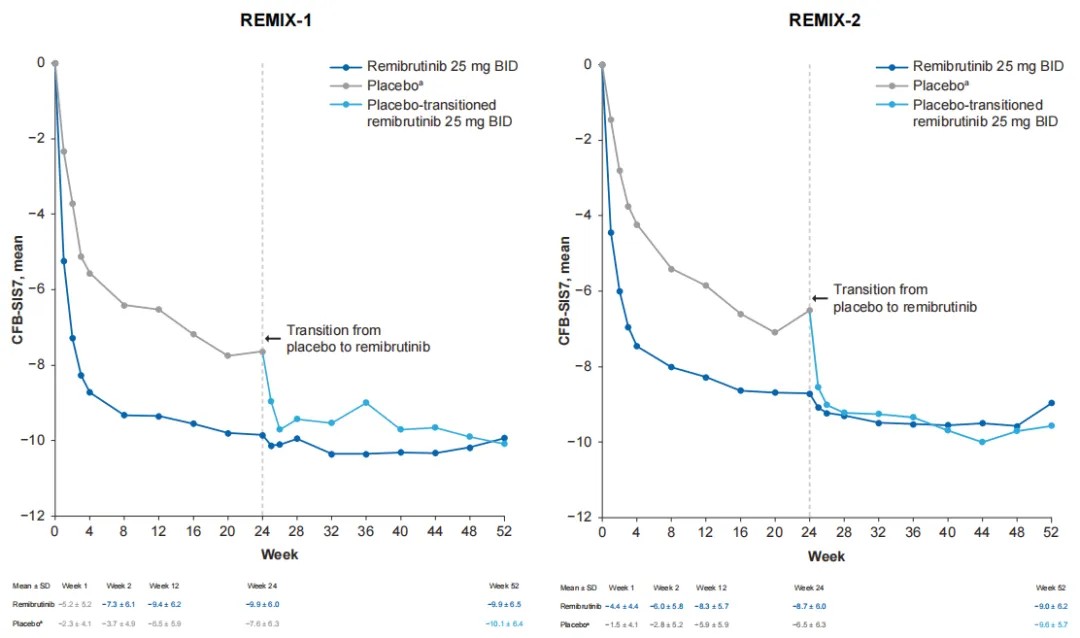
AIS7:每周活动干扰评分
总结瑞米布替尼作为一种新型BTK抑制剂,在治疗成人慢性自发性荨麻疹方面展现出了显著的疗效和良好的安全性。其快速起效及长期稳定的治疗效果,为患者带来了显著的生活质量改善。同时,多项正在进行中的研究也表明,瑞米布替尼可能在其他免疫介导的炎症性疾病治疗中发挥重要作用,未来有望扩展其应用范围并满足更多未被满足的医疗需求。这些数据进一步支持了瑞米布替尼作为慢性自发性荨麻疹治疗的重要潜力候选药物的地位。
瑞米布替尼治疗CSU的3期临床数据显示,患者在治疗1周后即显著缓解瘙痒和风团症状,至第52周时近半数实现症状完全消除(UAS7=0),且睡眠与日常活动干扰持续降低,长期安全性稳定。

